南通市妇幼保健院临床试验办事指南.docx
《赫尔辛基宣言》2024新变化.docx
关于印发涉及人的生命科学和医学研究伦理审查办法的通知.docx
科技伦理审查办法.docx
涉及人的临床研究伦理审查委员会建设指南.docx
第一章总则第一条为加强药物临床试验伦理审查工作的指导和监督管理,规范伦理委员会对药物临床试验的伦理审查工作,保证药物临床试验符合科学和伦理要求,根据《药物临床试验质量管理规范》(GCP)、世界医学会《赫尔辛基宣言》、国际医学科学组织...
第一章总则第一条为保证药物临床试验过程规范,数据和结果的科学、真实、可靠,保护受试者的权益和安全,根据《中华人民共和国药品管理法》《中华人民共和国疫苗管理法》《中华人民共和国药品管理法实施条例》,制定本规范。本规范适用于为申请药品...
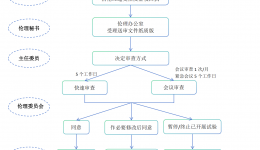
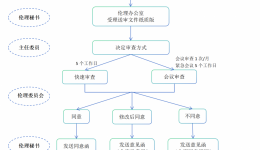
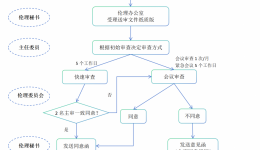
递交时限:(1)本中心的安全事件SAE/SUSAR:研究者应当立即(一般为获知后的24h内,除非在研究方案中另有约定)向伦理委员会书面报告所有严重不良事件,随后应当及时提供详尽、书面的随访报告和总结报告。申办者在收到SAE后应当立即分析评估,基于...